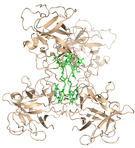
Während alle Chlorophyllproteine des pflanzlichen Photosyntheseapparats Membranproteine sind, gilt dies nicht für das "Water-soluble Chlorophyll Protein" WSCP, das in Brassicaceen und einigen weiteren Familien gefunden wird. Die Kristallstruktur zweier WSCPs ist beschrieben, aber die Funktion ist noch unklar. Die Expression des Proteins wird in vielen Fällen durch Stress oder Seneszenz induziert. Das WSCP weist nur geringe Sequenzähnlichkeit mit anderen Chlorophyll-bindenden Proteinen auf, besitzt aber eine Sequenzsignatur für Künitz-Trypsin-Inhibitoren. Eine herausstechende Eigenschaft des WSCP ist seine ungewöhnliche Stabilität: Selbst einstündiges Kochen in Wasser übersteht es unbeschadet!
In Arabidopsis wird WSCP spezifisch im Septum der Fruchtschoten akkumuliert (Ref.: Bektas et al., 2012). An rekombinantem WSCP konnten wir zeigen, dass das Protein sein gebundenes Chlorophyll sehr wirkungsvoll gegen Photooxidation schützt, obwohl es keine Carotinoide bindet (Ref.: Schmidt et al., 2003). Das Protein bietet mit seiner geringen Zahl an sehr spezifisch gebundenen Chlorophyll-Molekülen ein hervorragendes Modell zur Untersuchung von Chlorophyll-Chlorophyll- sowie Chlorophyll-Protein-Wechselwirkungen. (Zusammenarbeit mit Prof. T. Basché, JGU Mainz, Prof. D. Carbonera, Padua, Italien, Prof. J. Pieper, Tartu, Estland, Prof. T. Renger, Graz, Österreich, Dr. F.-J. Schmitt, TU Berlin. Ref.: Theiss et al., 2007; Schmitt et al., 2008; Renger et al., 2009; Pieper et al., 2011; Renger et al., 2011, Bektas et al. 2012, Palm et al. 2017, Agostini et al. 2017).