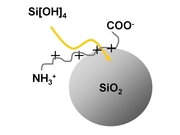
Kieselalgen (Diatomeen) sind einzellige photoautotrophe Organismen, die sich mit einer zweigeteilten Schale aus Silikat umgeben. Die beiden Schalenhälften bestehen aber nicht nur aus amorph polymerisertem SiO2. Sie enthalten darüber hinaus langkettige Polyamine und Silaffine, die bei der Verknüpfung der Kieselsäure-Monomere [Si(OH)4] zum SiO2 von entscheidender Bedeutung sind. Silaffine sind kurze kationische Peptide mit charakteristischen posttranslationalen Modifikationen (Kröger et al., Proc. Natl. Acad. Sci. USA 97, 14133-14138, 2000; Kröger et al., J. Biol. Chem. 276, 26066-26070, 2001).
Ausgehend von rekombinantem Silaffin konstruieren wir Peptide, die die Silikatpolymerisation in geeigneter Weise initiieren. Sowohl die Länge der Peptide als auch die Aminosäure¬abfolge werden variiert und dann auf ihre Silikat-fällenden Eigenschaften hin untersucht (Ref.: Roeder et al., 2014; Zerfaß et al; 2015). In Zusammenarbeit mit Prof. W. Tremel (Anorganische Chemie, JGU Mainz) haben wir per „phage display“ ein Peptid konstruiert, das spezifisch an das Calciumcarbonat-Polymorph Vaterit bindet (Ref.: Schüler et al., 2014, Spinthaki et al. 2017, Zerfaß et al. 2017).